ATP'nin oluşumu olan Krebs döngüsünün sonucu nedir? Krebs döngüsü, biyolojik rol, ana reaksiyonlar
PVK dehidrojenaz reaksiyonunda oluşan asetil-SCoA daha sonra devreye girer trikarboksilik asit döngüsü(TCA döngüsü, sitrik asit döngüsü, Krebs döngüsü). Döngüye piruvatın yanı sıra katabolizma sonucu gelen keto asitler de katılır. amino asitler veya başka maddeler.
Trikarboksilik asit döngüsü
Döngü devam ediyor Mitokondriyal matriks ve temsil eder oksidasyon moleküller asetil-SCoA sekiz ardışık reaksiyonda.
İlk reaksiyonda bağlanırlar asetil Ve oksaloasetat(oksaloasetik asit) oluşturmak için sitrat(sitrik asit), daha sonra sitrik asidin izomerizasyonu meydana gelir izositrat ve eş zamanlı CO2 salınımı ve NAD'ın indirgenmesiyle birlikte iki dehidrojenasyon reaksiyonu.
Beşinci reaksiyonda GTP oluşur, bu reaksiyondur substrat fosforilasyonu. Daha sonra FAD'a bağlı dehidrojenasyon sırayla gerçekleşir süksinat(süksinik asit), hidrasyon fumarova asit malat(malik asit), ardından NAD'a bağlı dehidrojenasyon oluşumuyla sonuçlanır oksaloasetat.
Sonuç olarak döngünün sekiz reaksiyonundan sonra Tekrar oksaloasetat oluşur .
Son üç reaksiyon, sözde biyokimyasal motifi (FAD'a bağlı dehidrojenasyon, hidrasyon ve NAD'a bağlı dehidrojenasyon) oluşturur; süksinat yapısına bir keto grubu eklemek için kullanılır. Bu motif aynı zamanda yağın β-oksidasyon reaksiyonlarında da mevcuttur. asitler Ters sırada (indirgeme, de Hidrasyon ve indirgeme) bu motif, yağ asidi sentezi reaksiyonlarında gözlenir.
TsTK'nın İşlevleri
1. Enerji
- nesil hidrojen atomları solunum zincirinin işleyişi için, yani üç molekül NADH ve bir molekül FADH2,
- tek molekül sentezi GTF(ATP'ye eşdeğer).
2. Anabolik. TTK'da oluşur
- hem öncüsü süksinil-SCoA,
- Amino asitlere dönüştürülebilen keto asitler α-ketoglutarat glutamik asit için, oksaloasetat aspartik asit için,
- limon asidi yağ asitlerinin sentezinde kullanılır,
- oksaloasetat Glikoz sentezi için kullanılır.

TCA döngüsünün anabolik reaksiyonları
Trikarboksilik asit döngüsünün düzenlenmesi
Allosterik düzenleme
TCA döngüsünün 1., 3. ve 4. reaksiyonlarını katalize eden enzimler aşağıdakilere duyarlıdır: Allosterik düzenleme metabolitler:
Oksaloasetat mevcudiyetinin düzenlenmesi
Ana Ve temel TCA döngüsünün düzenleyicisi oksaloasetattır, daha doğrusu onun mevcudiyetidir. Oksaloasetatın varlığı asetil-SCoA'yı TCA döngüsüne dahil eder ve süreci başlatır.
Genellikle hücre vardır denge asetil-SCoA oluşumu (glikoz, yağ asitleri veya amino asitlerden) ile oksaloasetat miktarı arasında. Oksaloasetatın kaynağı piruvat, (glikoz veya alaninden oluşur), elde edilen aspartik asit transaminasyon veya AMP-IMP döngüsünün bir sonucu olarak ve ayrıca meyve asitleri amino asitlerin katabolizması sırasında oluşabilen veya diğer işlemlerden gelebilen döngünün kendisi (süksinik, α-ketoglutarik, malik, sitrik).

Piruvattan oksaloasetat sentezi
Enzim aktivitesinin düzenlenmesi piruvat karboksilaz katılımıyla gerçekleştirilen asetil-SCoA. Bu allosterik aktivatör enzim ve onsuz piruvat karboksilaz pratik olarak etkisizdir. Asetil-SCoA biriktiğinde enzim çalışmaya başlar ve oksaloasetat oluşur, ancak elbette yalnızca piruvat varlığında.
Ayrıca çoğunluk amino asitler Katabolizmaları sırasında TCA döngüsünün metabolitlerine dönüşebilirler ve bunlar daha sonra döngünün aktivitesini de koruyan oksaloasetata dönüşürler.

TCA döngüsü metabolit havuzunun amino asitlerden yenilenmesi
Döngünün yeni metabolitlerle (oksaloasetat, sitrat, a-ketoglutarat, vb.) yenilenmesi reaksiyonlarına denir. anaplerotik.
Oksaloasetatın metabolizmadaki rolü
Önemli bir rol örneği oksaloasetat keton cisimlerinin sentezini aktive etmeye yarar ve ketoasidoz kan plazması yetersiz oksaloasetat miktarı karaciğerde. Bu durum insüline bağımlı diyabetin (tip 1 diyabet) dekompansasyonu sırasında ve oruç sırasında gözlenir. Bu bozukluklarla karaciğerde glukoneogenez süreci aktive olur, yani. oksaloasetat miktarında bir azalmaya yol açan oksaloasetat ve diğer metabolitlerden glikoz oluşumu. Yağ asidi oksidasyonunun eşzamanlı aktivasyonu ve asetil-SCoA birikimi, asetil grubunun kullanımı için bir yedek yolu tetikler. keton cisimlerinin sentezi. Bu durumda vücutta kan asitlenmesi gelişir ( ketoasidoz) karakteristik bir klinik tabloyla: halsizlik, baş ağrısı, uyuşukluk, kas tonusunda azalma, vücut ısısı ve kan basıncı.

TCA döngüsü reaksiyonlarının hızındaki değişiklikler ve belirli koşullar altında keton cisimciklerinin birikmesinin nedenleri
Oksaloasetat katılımıyla açıklanan düzenleme yöntemi, güzel formülasyonun bir örneğidir " Yağlar karbonhidratların alevinde yanar"Bu, glikozun "yanma alevinin" piruvatın ortaya çıkmasına yol açtığını ve piruvatın yalnızca asetil-SCoA'ya değil aynı zamanda oksaloasetat. Oksaloasetat varlığı, aşağıdakilerden oluşan asetil grubunun dahil edilmesini sağlar yağ asitleri TCA döngüsünün ilk reaksiyonunda asetil-SCoA formunda.
Kaslarda gözlenen yağ asitlerinin büyük ölçekli "yanması" durumunda fiziksel iş ve karaciğerde oruç Asetil-SCoA'nın TCA döngüsü reaksiyonuna giriş hızı doğrudan oksaloasetat (veya oksitlenmiş glikoz) miktarına bağlı olacaktır.
Oksaloasetat miktarı ise hepatosit yeterli değilse (glikoz yoktur veya pirüvata oksitlenmez), o zaman asetil grubu keton cisimlerinin sentezine gidecektir. Bu ne zaman olur uzun oruç Ve tip 1 diyabet.
Krebs döngüsü.
Turna balığı asetatı "yedi",
Sonuç sitrattır.
Cis-aconitate aracılığıyla
İzositrat olacak.
OVER'a hidrojen verilmesi,
CO2 kaybeder.
Bu konuda son derece mutluyum
Alfa-keto-glutarat.
Oksidasyon geliyor:
NAD hidrojeni çalacak,
B 1 ve lipoat
Koenzim A konusunda aceleleri var,
CO2 toplanır.
Ve enerji zar zor
Süksinilde ortaya çıktı,
ATF hemen doğdu.
Ve geriye süksinat kaldı.
Şimdi FAD'a gitti -
Hidrojene ihtiyacı var.
Hidrojenleri kaybettikten sonra,
Sadece fumarat oldu.
Fumarat su içti,
Evet malata dönüştü.
Burada NAD malatlaşmaya geldi,
Hidrojen satın alındı.
PIKE yeniden ortaya çıktı
Ve sessizce saklandım
Koruma asetatı...
Enzimler bu diyagramda var.
Koenzimler- NAD, NADP, ATP, GTP mi? Sonra var.
Şema:







Ortaya çıkan PCA molekülleri yeni bir Asetil-CoA molekülü ile reaksiyona girer ve döngü tekrar tekrarlanır.
Bir devrimin enerji dengesi: 3 NADH 2 + 1 FADH 2 (ayrıca oksidatif fosforilasyonun solunum zincirine gönderilir) + 1 GTP (NADH 2 -> 3 ATP, FADH 2 -> 2 ATP, GTP -> 1 ATP) = 12 ATP.
TCA döngüsünün düzenlenmesi: 4 düzenleyici enzim: sitrat sentaz, izositrat DG, α-KG DG ve SDH. TCA döngüsü esas olarak TCA döngüsünün ve oksidatif fosforilasyon zincirinin ürünleri olan NADH2 ve ATP tarafından inhibe edilir. TCA döngüsü esas olarak NAD + ve ADP tarafından etkinleştirilir.
Hücrede oksijenin kullanılmasına yönelik oksidaz yolu mitokondriyal oksidatif fosforilasyondur. Redoks zincirinin solunum komplekslerinin bileşimi, lokalizasyonu ve fonksiyonları, çocukluk çağında doku özellikleri. Düzenleme.
Hücrede oksijen kullanımı için oksidaz yolu:
Mitokondride meydana gelir, O2'nin %90'ını tüketir ve oksidatif fosforilasyon sürecini sağlar.
Oksidatif fosforilasyon- Solunum zinciri boyunca elektron hareketinin enerjisinden dolayı ADP ve H3PO4'ten ATP sentezi.
Aerobik hücrelerdeki ATP'nin ana kaynağıdır.
Oksidatif fosforilasyon süreçlerden oluşur oksidasyon Ve fosforilasyon.
1) Oksidasyon süreci
Oksidasyon süreci, elektronlar solunum zinciri boyunca doku solunumunun substratlarından oksijene doğru hareket ettiğinde meydana gelir. Oksidatif fosforilasyonun solunum zinciri, mitokondrinin iç zarına gömülü 4 protein kompleksinden ve protein kompleksleri arasındaki zarın lipit tabakasında dolaşan küçük hareketli ubikinon ve sitokrom C moleküllerinden oluşur.

A. Kompleks I – NADH 2 dehidrojenaz kompleksi – Solunum enzim komplekslerinin en büyüğü olup koenzim olarak FMN ve 5 demir-sülfür (Fe 2 S 2 ve Fe 4 S 4) proteinlerini içerir.
B. Kompleks II – SDH. Koenzim olarak FAD ve demir-kükürt proteini içerir.
C. Kompleks III – Kompleks b-c 1 (enzim QH 2 DG). Her monomer sitokrom b 562, b 566, c 1 ve demir-kükürt proteini ile ilişkili 3 hem içerir.
D. Kompleks IV – Sitokrom oksidaz kompleksi. Her monomer 2 sitokrom (a ve a 3) ve 2 bakır atomu içerir.
e. Koenzim Q (ubikinon). 2H + ve 2e -'yi aktarır.
F. Sitokrom C. Periferik suda çözünür membran proteini. Hem molekülü içerir.
Hareket aşamaları e - solunum zinciri boyunca
A. 2e - NADH2'den kompleks I'den (FMN→SFe proteini) CoQ'ya geçer, bu durumda açığa çıkan enerji H +'nın pompalanmasını sağlar.
B. 2е ile CoQ - matristen sudan 2H+ alır ve CoQH 2'ye dönüşür (CoQ azalması ayrıca kompleks II'nin katılımıyla da gerçekleşir).
C. CoQH2, 2e -'yi kompleks III'e ve 2H +'yı zarlar arası boşluğa aktarır.
D. Sitokrom C, kompleks III'ün e - c'sini kompleks IV'e aktarır.
e. Kompleks IV e-'yi O2'nin üzerine boşaltır, bu durumda açığa çıkan enerji H+'nın pompalanmasını sağlar.
İç mitokondriyal membranda oluşan elektrokimyasal potansiyel şu amaçlarla kullanılır:
A. ADP'nin ATP'ye fosforilasyonu;
B. maddelerin mitokondriyal membran boyunca taşınması;
C. ısı üretimi.
2) Fosforilasyon süreci
Fosforilasyon işlemi, oksidasyon sırasında açığa çıkan serbest enerjinin %40-45'ini tüketen ATP sentetaz (H+ -ATPase) tarafından gerçekleştirilir. H + -ATPase, mitokondrinin iç zarının ayrılmaz bir proteinidir; 2 protein kompleksi F 0 ve F 1'den oluşur.
A. Hidrofobik kompleks F 0 membrana daldırılır ve membranda ATP sentazını sabitleyen bir baz görevi görür. Protonların matrise taşındığı bir kanal oluşturan birkaç alt birimden oluşur.
B. Kompleks F 1 mitokondri matriksine doğru uzanır. 9 alt birimden oluşur (3α, 3β, γ, δ, ε). α ve β alt birimleri bir "baş" oluşturacak şekilde çiftler halinde istiflenir; a- ve β-alt birimleri arasında ATP sentezinin meydana geldiği 3 aktif merkez vardır; γ, δ, ε - alt birimler F 1 kompleksini F 0'a bağlar.
ATP sentetaz, elektrokimyasal potansiyelin enerjisi ile kimyasal bağların enerjisinin tersinir bir şekilde birbirine dönüştürülmesini sağlar.
İç zarın elektrokimyasal potansiyeli, H+'nın zarlar arası boşluktan ATP sentaz kanalı yoluyla mitokondriyal matrikse doğru hareket etmesine neden olur. Protonların Fo kanalı yoluyla her transferinde, elektrokimyasal potansiyelin enerjisi çubuğu döndürmek için harcanır, bunun sonucunda a- ve β-alt birimlerinin konformasyonu döngüsel olarak değişir ve 3 aktif merkezin tümü çiftlerden oluşur. a- ve β-alt birimleri döngünün bir sonraki aşamasını katalize eder: 1) ADP ve H3P04'ün bağlanması; 2) ATP'nin fosfoanhidrit bağının oluşumu; 3) son ürün ATP'nin serbest bırakılması.
TRİKARBOKSİLİK ASİTLER DÖNGÜSÜ (KREBS DÖNGÜSÜ)
Glikoliz, glikozu piruvata dönüştürür ve bir glikoz molekülünden iki ATP molekülü üretir; bu molekülün potansiyel enerjisinin küçük bir kısmıdır.
Aerobik koşullar altında piruvat, glikolizden asetil-CoA'ya dönüştürülür ve trikarboksilik asit döngüsünde (sitrik asit döngüsü) CO2'ye oksitlenir. Bu durumda, bu döngünün reaksiyonlarında salınan elektronlar, NADH ve FADH2'den son alıcı olan 02'ye geçer. Elektron taşınması, mitokondriyal membranda bir proton gradyanı oluşturulmasıyla ilişkilidir; bunun enerjisi daha sonra oksidatif fosforilasyonun bir sonucu olarak ATP'nin sentezi için kullanılır. Bu tepkileri ele alalım.
Aerobik koşullar altında, piruvik asit (1. aşama), glikoz parçalanmasının son ürünlerine - CO2 ve H - oksitlenebilen asetil-CoA (2. aşama) oluşumuyla laktik asite dönüşümden daha verimli olan oksidatif dekarboksilasyona uğrar. 2 0 (3. aşama). Bireysel organik asitlerin oksidasyonunu inceleyen Alman biyokimyacı G. Krebs (1900-1981), reaksiyonlarını tek bir döngüde birleştirdi. Bu nedenle trikarboksilik asit döngüsüne genellikle onun onuruna Krebs döngüsü adı verilir.
Piruvik asidin asetil-CoA'ya oksidasyonu, mitokondride üç enzimin (piruvat dehidrojenaz, lipoamid dehidrojenaz, lipoil asetiltransferaz) ve beş koenzimin (NAD, FAD, tiamin pirofosfat, lipoik asit amid, koenzim A) katılımıyla meydana gelir. Bu dört koenzim, karbonhidratların normal oksidasyonu için bu vitaminlere olan ihtiyacı gösteren B vitaminlerini (B x, B 2, B 3, B 5) içerir. Bu karmaşık enzim sisteminin etkisi altında piruvat, oksidatif dekarboksilasyon reaksiyonunda asetik asit - asetil koenzim A'nın aktif formuna dönüştürülür:
Fizyolojik koşullar altında piruvat dehidrojenaz, yalnızca geri dönüşü olmayan bir enzimdir ve bu, yağ asitlerini karbonhidratlara dönüştürmenin imkansızlığını açıklar.
Asetil-CoA molekülünde yüksek enerjili bir bağın varlığı, bu bileşiğin yüksek reaktivitesini gösterir. Asetil-CoA özellikle mitokondride enerji üretmek için etki gösterebilir; karaciğerde asetil-CoA'nın fazlası keton cisimciklerinin sentezi için kullanılır; sitozolde steroidler ve yağ asitleri gibi karmaşık moleküllerin sentezine katılır.
Piruvik asidin oksidatif dekarboksilasyonu reaksiyonunda elde edilen asetil-CoA, trikarboksilik asit döngüsüne (Krebs döngüsü) girer. Karbonhidratların, yağların ve amino asitlerin oksidasyonunun son katabolik yolu olan Krebs döngüsü aslında bir “metabolik kazandır”. Yalnızca mitokondride meydana gelen Krebs döngüsünün reaksiyonlarına sitrik asit döngüsü veya trikarboksilik asit döngüsü (TCA döngüsü) de denir.
Trikarboksilik asit döngüsünün en önemli işlevlerinden biri, indirgenmiş koenzimlerin (3 molekül NADH + H + ve 1 molekül FADH2) üretilmesi ve ardından hidrojen atomlarının veya elektronlarının son alıcıya - moleküler oksijene aktarılmasıdır. Bu taşınmaya, bir kısmı ATP formunda depolama için oksidatif fosforilasyon sürecinde kullanılan serbest enerjide büyük bir azalma eşlik eder. Trikarboksilik asit döngüsünün aerobik, oksijene bağımlı olduğu açıktır.
1. Trikarboksilik asit döngüsünün ilk reaksiyonu, sitrik asit oluşturmak üzere mitokondriyal matris enzimi sitrat sentazın katılımıyla asetil-CoA ve oksaloasetik asidin yoğunlaşmasıdır.

2. Bir su molekülünün sitrattan uzaklaştırılmasını katalize eden akonitaz enziminin etkisi altında, ikincisi dönüşür

cis-akonitik asit. Su cis-akonitik asitle birleşerek izositrik asite dönüşür.
3. İzositrat dehidrojenaz enzimi daha sonra, izositrik asit oksidatif dekarboksilasyon yoluyla a-ketoglutarik asite dönüştürüldüğünde sitrik asit döngüsünün ilk dehidrojenaz reaksiyonunu katalize eder:

Bu reaksiyonda CO2'nin ilk molekülü ve NADH 4-H+ döngüsünün ilk molekülü oluşur.
4. a-ketoglutarik asidin süksinil-CoA'ya daha fazla dönüşümü, a-ketoglutarik dehidrojenazın çoklu enzim kompleksi tarafından katalize edilir. Bu reaksiyon kimyasal olarak piruvat dehidrojenaz reaksiyonuna benzer. Lipoik asit, tiamin pirofosfat, HS-KoA, NAD+, FAD içerir. 
Bu reaksiyon sonucunda yeniden NADH+H+ ve CO2 molekülü oluşur.
5. Süksinil-CoA molekülü, enerjisi bir sonraki reaksiyonda GTP formunda depolanan yüksek enerjili bir bağa sahiptir. Süksinil-CoA sentetaz enziminin etkisi altında süksinil-CoA, serbest süksinik asite dönüştürülür. Süksinik asidin, tek sayıda karbon atomuna sahip yağ asitlerinin oksidasyonu yoluyla metilmalonil-CoA'dan da elde edilebileceğini unutmayın.

Bu reaksiyon, substrat fosforilasyonunun bir örneğidir, çünkü bu durumda yüksek enerjili GTP molekülü, elektron ve oksijen taşıma zincirinin katılımı olmadan oluşur.
6. Süksinik asit, süksinat dehidrojenaz reaksiyonunda fumarik asite oksitlenir. Koenzimi FAD olan tipik bir demir-kükürt içeren enzim olan süksinat dehidrojenaz. Süksinat dehidrojenaz, iç mitokondriyal membrana bağlanan tek enzimdir, diğer tüm döngü enzimleri ise mitokondriyal matriste bulunur. 
7. Bunu, fizyolojik koşullar altında geri dönüşümlü bir reaksiyonla fumaraz enziminin etkisi altında fumarik asidin malik asite hidrasyonu takip eder:

8. Trikarboksilik asit döngüsünün son reaksiyonu, aktif enzim mitokondriyal NADy'ye bağımlı malat dehidrojenazın katılımıyla malat dehidrojenaz reaksiyonudur; burada indirgenmiş NADH + H +'nın üçüncü molekülü oluşturulur:

Oksaloasetik asitin (oksaloasetat) oluşumu, trikarboksilik asit döngüsünün bir devrimini tamamlar. Oksalasetik asit, ikinci bir asetil-CoA molekülünün oksidasyonunda kullanılabilir ve bu reaksiyon döngüsü birçok kez tekrarlanarak sürekli olarak oksaloasetik asit üretimine yol açabilir.
Böylece, TCA döngüsünde bir molekül asetil-CoA'nın döngünün bir substratı olarak oksidasyonu, bir molekül GTP, üç molekül NADP + H + ve bir molekül FADH2'nin üretilmesine yol açar. Bu indirgeyici ajanların biyolojik oksidasyon zincirinde oksidasyonu

lenisyon 12 ATP molekülünün sentezine yol açar. Bu hesaplama "Biyolojik oksidasyon" konusundan açıkça anlaşılmaktadır: bir NAD + molekülünün elektron taşıma sistemine dahil edilmesine sonuçta 3 ATP molekülünün oluşumu eşlik eder, bir FADH2 molekülünün dahil edilmesi 2 ATP molekülünün oluşumunu sağlar, ve bir GTP molekülü 1 ATP molekülüne eşdeğerdir.
İzositrat dehidrojenaz ve alfa-ketoglutarat dehidrojenaz tarafından katalize edilen dekarboksilasyon reaksiyonlarında adetil-CoA'nın iki karbon atomunun trikarboksilik asit döngüsüne girdiğini ve iki karbon atomunun döngüden CO2 olarak ayrıldığını unutmayın.
Aerobik koşullar altında bir glikoz molekülünün C0 2 ve H 2 0'a tamamen oksidasyonu ile ATP formunda enerji oluşumu:
- Bir glikoz molekülünün 2 molekül pirüvik asit (glikoliz) haline dönüştürülmesi sırasında 4 molekül ATP;
- 3-fosfogliseraldehit dehidrojenaz reaksiyonunda (glikoliz) oluşan 6 ATP molekülü;
- Piruvat dehidrojenaz reaksiyonunda iki pirüvik asit molekülünün oksidasyonu sırasında ve ardından trikarboksilik asit döngüsünde iki asetil-CoA molekülünün CO2 ve H20'ya dönüşümü sırasında 30 ATP molekülü oluşmuştur. Bu nedenle, bir glikoz molekülünün tamamen oksidasyonundan elde edilen toplam enerji çıkışı 40 ATP molekülü olabilir. Ancak glikozun oksidasyonu sırasında, glikozun glikoz-6-fosfata dönüştürülmesi aşamasında ve fruktoz-6-fosfatın fruktoz-1,6-'ye dönüştürülmesi aşamasında iki ATP molekülünün tüketildiği dikkate alınmalıdır. difosfat. Bu nedenle, bir glikoz molekülünün oksidasyonundan elde edilen "net" enerji çıkışı 38 ATP molekülüdür.
Anaerobik glikolizin enerjisini ve glikozun aerobik katabolizmasını karşılaştırabilirsiniz. Teorik olarak 1 gram glikoz molekülünde (180 g) bulunan 688 kcal enerjinin 20 kcal'i, anaerobik glikoliz reaksiyonlarında oluşan iki ATP molekülünde bulunur ve 628 kcal teorik olarak laktik asit formunda kalır.
Aerobik koşullar altında, 38 ATP molekülündeki bir gram glikoz molekülünün 688 kcal'inden 380 kcal elde edilir. Bu nedenle, aerobik koşullar altında glikoz kullanımının etkinliği, anaerobik glikolize göre yaklaşık 19 kat daha yüksektir.
Tüm oksidasyon reaksiyonlarının (trioz fosfatın oksidasyonu, pirüvik asit, trikarboksilik asit döngüsünün dört oksidasyon reaksiyonu) ADP ve fosfordan ATP sentezinde rekabet ettiğine dikkat edilmelidir (Pasteur etkisi). Bu, oksidasyon reaksiyonlarında ortaya çıkan NADH + H + molekülünün, hidrojeni oksijene aktaran solunum sistemi reaksiyonları ile hidrojeni piruvik aside aktaran LDH enzimi arasında bir seçime sahip olduğu anlamına gelir.
Trikarboksilik asit döngüsünün erken aşamalarında, asitleri, döngünün işleyişini bozmadan diğer hücre bileşiklerinin sentezine katılmak üzere döngüyü terk edebilir. Trikarboksilik asit döngüsü aktivitesinin düzenlenmesinde çeşitli faktörler rol oynar. Bunlar arasında öncelikle asetil-CoA moleküllerinin temini, piruvat dehidrojenaz kompleksinin aktivitesi, solunum zinciri bileşenlerinin aktivitesi ve bununla ilişkili oksidatif fosforilasyonun yanı sıra oksaloasetik asit seviyesinden de bahsedilmelidir.
Moleküler oksijen, trikarboksilik asit döngüsüne doğrudan dahil değildir, ancak reaksiyonları yalnızca aerobik koşullar altında gerçekleştirilir, çünkü NAD ~ ve FAD, mitokondride yalnızca elektronların moleküler oksijene aktarılmasıyla yeniden üretilebilir. Trikarboksilik asit döngüsünün aksine glikolizin anaerobik koşullar altında da mümkün olduğu vurgulanmalıdır, çünkü NAD~, piruvik asidin laktik asite geçişi sırasında yeniden üretilir.
Trikarboksilik asit döngüsünün, ATP oluşumunun yanı sıra başka bir önemli anlamı daha vardır: Döngü, vücudun çeşitli biyosentezleri için ara yapılar sağlar. Örneğin, porfirin atomlarının çoğu süksinil-CoA'dan gelir, birçok amino asit a-ketoglutarik ve oksaloasetik asitlerin türevleridir ve üre sentezi sürecinde fumarik asit oluşur. Bu, karbonhidratların, yağların ve proteinlerin metabolizmasındaki trikarboksilik asit döngüsünün bütünlüğünü gösterir.
Glikoliz reaksiyonlarının gösterdiği gibi çoğu hücrenin enerji üretme yeteneği mitokondride yatmaktadır. Çeşitli dokulardaki mitokondri sayısı, dokuların fizyolojik işlevleriyle ilişkilidir ve aerobik koşullara katılma yeteneklerini yansıtır. Örneğin, kırmızı kan hücrelerinde mitokondri yoktur ve bu nedenle son elektron alıcısı olarak oksijeni kullanarak enerji üretme yeteneği yoktur. Ancak aerobik koşullar altında çalışan kalp kasında hücre sitoplazmasının hacminin yarısı mitokondri tarafından temsil edilir. Karaciğer de çeşitli işlevleri için aerobik koşullara bağımlıdır ve memeli hepatositleri hücre başına 2 bine kadar mitokondri içerir.
Mitokondri iki zar içerir - dış ve iç. Dış zar daha basittir; %50 yağ ve %50 proteinden oluşur ve nispeten daha az işleve sahiptir. İç zar yapısal ve işlevsel olarak daha karmaşıktır. Hacminin yaklaşık %80'i proteinlerden oluşur. Elektron taşınmasında ve oksidatif fosforilasyonda rol oynayan enzimlerin çoğunu, metabolik aracıları ve sitozol ile mitokondriyal matris arasındaki adenin nükleotidlerini içerir.
NAD +, NADH, NADP +, FAD ve FADH 2 gibi redoks reaksiyonlarında yer alan çeşitli nükleotitler, iç mitokondriyal membrana nüfuz etmez. Asetil-CoA, mitokondriyal bölmeden, yağ asitleri veya sterollerin sentezi için gerekli olduğu sitozole geçemez. Bu nedenle intramitokondriyal asetil-CoA, trikarboksilik asit döngüsünün sitrat sentaz reaksiyonuna dönüştürülür ve bu formda sitozole girer.
TRİKARBOKSİLİK ASİTLER DÖNGÜSÜ Sitrik asit döngüsü veya Krebs döngüsü, proteinlerin, yağların ve karbonhidratların parçalanması ve sentezi sırasında ara ürünler olarak oluşan di- ve trikarboksilik asitlerin oksidatif dönüşümleri için hayvan, bitki ve mikrop organizmalarında yaygın olarak temsil edilen bir yoldur. H. Krebs ve W. Johnson (1937) tarafından keşfedilmiştir. Bu döngü metabolizmanın temelidir ve iki önemli işlevi yerine getirir: vücuda enerji sağlamak ve hem katabolik (biyolojik bozunma) hem de anabolik (biyosentez) tüm ana metabolik akışları bütünleştirmek.
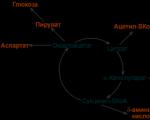
Krebs döngüsü 8 aşamadan oluşur (ara ürünler diyagramda iki aşamada vurgulanmıştır), bu süreçte aşağıdakiler meydana gelir:
1) asetil kalıntısının iki C02 molekülüne tamamen oksidasyonu,
2) döngüde üretilen enerjinin ana kaynağı olan üç molekül indirgenmiş nikotinamid adenin dinükleotid (NADH) ve bir indirgenmiş flavin adenin dinükleotid (FADH 2) oluşur ve
3) Substrat oksidasyonunun bir sonucu olarak bir molekül guanozin trifosfat (GTP) oluşur.
Genel olarak yol enerji açısından faydalıdır (DG 0 " = –14,8 kcal.)
Mitokondride lokalize olan Krebs döngüsü sitrik asit (sitrat) ile başlar ve oksaloasetik asit (oksaloasetat - OA) oluşumu ile sona erer. Döngünün substratları arasında trikarboksilik asitler - sitrik, sis-akonitik, izositrik, oksalosüksinat (oksalosüksinat) ve dikarboksilik asitler - 2-ketoglutarik (KG), süksinik, fumarik, malik (malat) ve oksaloasetik bulunur. Krebs döngüsünün substratları ayrıca aktif formunda (yani asetil koenzim A, asetil-SCoA formunda) oksaloasetik asit ile yoğunlaşmaya katılan ve sitrik asit oluşumuna yol açan asetik asidi de içerir. Oksitlenen sitrik asitin yapısında yer alan asetil kalıntısıdır; karbon atomları C02'ye oksitlenir, hidrojen atomları kısmen dehidrojenazların koenzimleri tarafından kabul edilir ve kısmen protonlanmış formda çözeltiye, yani çevreye geçer.
Glikoliz sırasında oluşan ve kesişen metabolik yollarda merkezi yerlerden birini işgal eden piruvik asit (piruvat), genellikle asetil-CoA oluşumunun başlangıç bileşiği olarak gösterilir. Karmaşık bir yapıya sahip bir enzimin etkisi altında - piruvat dehidrojenaz (CP1.2.4.1 - PDHase), piruvat, CO2 (ilk dekarboksilasyon), asetil-CoA oluşturacak şekilde oksitlenir ve NAD ( santimetre. diyagram). Bununla birlikte, piruvatın oksidasyonu, aynı zamanda yağ asitlerinin (tiolaz enzimi veya yağ asidi sentetazı) oksidasyonunun ve karbonhidratların ve amino asitlerin ayrışmasının diğer reaksiyonlarının karakteristik bir ürünü olan asetil-CoA'yı oluşturmanın tek yolu olmaktan uzaktır. Krebs döngüsünün reaksiyonlarında yer alan tüm enzimler mitokondride lokalizedir, çoğu çözünürdür ve süksinat dehidrojenaz (KF1.3.99.1) membran yapılarıyla sıkı bir şekilde ilişkilidir.
Sitrat sentaz (EC4.1.3.7 - şemadaki yoğunlaşan enzim) yardımıyla, sentezi uygun şekilde başlayan sitrik asit oluşumu, endergonik bir reaksiyondur (enerji emilimi ile) ve uygulanması. asetil kalıntısının KoA [CH3CO~SKoA] ile enerji açısından zengin bağının kullanılması nedeniyle mümkündür. Bu, tüm döngünün düzenlenmesinin ana aşamasıdır. Bunu, cis-akonitik asit oluşumunun ara aşaması yoluyla sitrik asidin izositrik asit halinde izomerizasyonu takip eder (akonitaz KF4.2.1.3 enzimi, mutlak stereospesifikliğe sahiptir - hidrojenin konumuna duyarlıdır). İzositrik asidin karşılık gelen dehidrojenazın (izositrat dehidrojenaz KF1.1.1.41) etkisi altında daha fazla dönüştürülmesinin ürünü, görünüşe göre oksalosüksinik asittir ve bunun dekarboksilasyonu (ikinci CO2 molekülü) CG'ye yol açar. Bu aşama da sıkı bir şekilde düzenlenmiştir. Bir dizi özellik bakımından (yüksek moleküler ağırlık, karmaşık çok bileşenli yapı, adım adım reaksiyonlar, kısmen aynı koenzimler, vb.) KH dehidrojenaz (EC1.2.4.2) PDHase'e benzer. Reaksiyon ürünleri C02 (üçüncü dekarboksilasyon), H+ ve süksinil-CoA'dır. Bu aşamada, süksinat tiokinaz (EC6.2.1.4) olarak da adlandırılan süksinil-CoA sentetaz etkinleştirilir ve serbest süksinat oluşumunun tersine çevrilebilir reaksiyonunu katalize eder: Süksinil-CoA + P inorg + GDP = Süksinat + KoA + GTP. Bu reaksiyon sırasında substrat fosforilasyonu adı verilen olay meydana gelir; süksinil-CoA'nın enerjisini kullanarak guanozin difosfat (GDP) ve mineral fosfat (P inorg) pahasına enerji açısından zengin guanozin trifosfatın (GTP) oluşumu. Süksinat oluşumundan sonra bir flavoprotein olan süksinat dehidrojenaz (KF1.3.99.1) devreye girerek fumarik asite yol açar. FAD, enzimin protein kısmına bağlıdır ve riboflavin'in (B2 vitamini) metabolik olarak aktif formudur. Bu enzim aynı zamanda hidrojen eliminasyonunda mutlak stereospesifiklik ile de karakterize edilir. Fumaraz (EC4.2.1.2), fumarik asit ile malik asit (ayrıca stereospesifik) arasındaki dengeyi sağlar ve malik asit dehidrojenaz (NAD+ koenzimi gerektiren malat dehidrojenaz EC1.1.1.37 de stereospesifiktir) tamamlanmasına yol açar Krebs döngüsü, yani oksaloasetik asit oluşumu. Bundan sonra oksaloasetik asidin asetil-CoA ile yoğunlaşma reaksiyonu tekrarlanarak sitrik asit oluşumuna yol açar ve döngü devam eder.
Süksinat dehidrojenaz, solunum zincirinin daha karmaşık süksinat dehidrojenaz kompleksinin (kompleks II) bir parçasıdır ve reaksiyon sırasında oluşan indirgeyici eşdeğerleri (NAD-H2) solunum zincirine sağlar.
PDHase örneğini kullanarak, karşılık gelen enzimin özel kinaz ve fosfataz PDHase tarafından fosforilasyonu-defosforilasyonu nedeniyle metabolik aktivitenin kademeli düzenlenmesi ilkesi hakkında bilgi sahibi olabilirsiniz. Her ikisi de PDGase'e bağlı.
Bireysel enzimatik reaksiyonların katalizinin, "metabolon" olarak adlandırılan supramoleküler bir "süper kompleksin" parçası olarak gerçekleştirildiği varsayılmaktadır. Böyle bir enzim organizasyonunun avantajları, kofaktörlerin (koenzimler ve metal iyonları) ve substratların difüzyonunun olmamasıdır ve bu, döngünün daha verimli çalışmasına katkıda bulunur.
Dikkate alınan süreçlerin enerji verimliliği düşüktür, ancak piruvatın oksidasyonu sırasında oluşan 3 mol NADH ve 1 mol FADH2 ve Krebs döngüsünün sonraki reaksiyonları oksidatif dönüşümlerin önemli ürünleridir. Bunların daha ileri oksidasyonu, mitokondride de solunum zincirinin enzimleri tarafından gerçekleştirilir ve fosforilasyonla ilişkilidir, yani. mineral fosfatın esterifikasyonu (organofosfor esterlerinin oluşumu) nedeniyle ATP oluşumu. Glikoliz, PDHase'in enzimatik etkisi ve Krebs döngüsü (toplam 19 reaksiyon), 38 molekül ATP'nin oluşmasıyla bir glikoz molekülünün 6 molekül C02'ye tamamen oksidasyonunu belirler - bu pazarlık kozu "enerji para birimi"dir. hücre. NADH ve FADH2'nin solunum zincirinin enzimleri tarafından oksidasyon süreci enerjik olarak çok verimlidir, atmosferik oksijen kullanılarak gerçekleşir, su oluşumuna yol açar ve hücrenin enerji kaynaklarının ana kaynağı olarak hizmet eder (% 90'dan fazla). Ancak Krebs döngüsünün enzimleri bunun doğrudan uygulanmasında yer almaz. Her insan hücresinde hayati enerji sağlayan 100 ila 1000 mitokondri bulunur.
Krebs döngüsünün metabolizmadaki bütünleştirici fonksiyonunun temeli, proteinlerdeki karbonhidratların, yağların ve amino asitlerin sonuçta bu döngünün ara maddelerine (ara maddelere) dönüştürülebilmesi veya onlardan sentezlenebilmesidir. Anabolizma sırasında ara maddelerin döngüden çıkarılması, biyosentez için gerekli ATP'nin sürekli oluşumu için döngünün katabolik aktivitesinin devamı ile birleştirilmelidir. Bu nedenle döngünün iki işlevi aynı anda yerine getirmesi gerekir. Aynı zamanda ara maddelerin (özellikle OA) konsantrasyonu azalabilir ve bu da enerji üretiminde tehlikeli bir düşüşe yol açabilir. Bunu önlemek için anaplerotik reaksiyonlar (Yunanca “doldurmak” kelimesinden gelir) adı verilen “emniyet valfleri” vardır. En önemli reaksiyon, yine mitokondride lokalize olan piruvat karboksilaz (EC6.4.1.1) tarafından gerçekleştirilen, piruvattan OA'nın sentezidir. Sonuç olarak, sitrat ve diğer ara maddelerin sentezini sağlayan, Krebs döngüsünün normal şekilde çalışmasına izin veren ve aynı zamanda sonraki biyosentez için ara maddelerin sitoplazmaya çıkarılmasını sağlayan büyük miktarda OA birikir. Böylece, Krebs döngüsü düzeyinde, anabolizma ve katabolizma süreçlerinin etkili bir şekilde koordine edilmiş entegrasyonu, hormonal olanlar da dahil olmak üzere çok sayıda ve incelikli düzenleyici mekanizmaların etkisi altında meydana gelir.
Anaerobik koşullar altında, Krebs döngüsü yerine oksidatif dal, KG'ye (reaksiyon 1, 2, 3) ve indirgeyici dal, OA'dan süksinata (reaksiyon 8®7®6) kadar işlev görür. Bu durumda fazla enerji depolanmaz ve döngü yalnızca hücresel sentez için ara maddeleri sağlar.
Vücut dinlenmeden aktiviteye geçtiğinde, enerjiyi ve metabolik süreçleri harekete geçirme ihtiyacı ortaya çıkar. Bu, özellikle hayvanlarda en yavaş reaksiyonların (1-3) ve süksinatın baskın oksidasyonunun yönlendirilmesiyle elde edilir. Bu durumda kısalmış Krebs döngüsünün başlangıç substratı olan KG, hızlı transaminasyon reaksiyonunda (amin grubu transferi) oluşur.
Glutamat + OA = CG + aspartat
Krebs döngüsünün bir başka modifikasyonu (sözde 4-aminobutirat şantı), KG'nin glutamat, 4-aminobutirat ve süksinik semialdehit (3-formilpropiyonik asit) yoluyla süksinata dönüştürülmesidir. Bu değişiklik, glikozun yaklaşık %10'unun bu yolla parçalandığı beyin dokusunda önemlidir.
Krebs döngüsünün, özellikle hayvan mitokondrisinde solunum zinciri ile yakın eşleşmesi ve ayrıca döngüdeki çoğu enzimin ATP'nin etkisi altında inhibisyonu, yüksek fosforil potansiyelinde döngünün aktivitesinde bir azalmayı belirler. hücre, yani yüksek bir ATP/ADP konsantrasyon oranında. Çoğu bitkide, bakteride ve birçok mantarda, eş zamanlı solunum ve döngü aktivitesinin yüksek fosforil potansiyelinde bile yüksek bir seviyede korunmasına izin veren, bağlanmamış alternatif oksidasyon yollarının geliştirilmesiyle sıkı bağlanmanın üstesinden gelinir.
İgor Rapanoviç
Herkes normal işleyiş için vücudun sağlıklı metabolizma için gerekli olan bir dizi besin maddesinin ve buna bağlı olarak enerji üretimi ve harcama süreçlerinin dengesinin düzenli olarak sağlanmasına ihtiyaç duyduğunu bilir. Bilindiği gibi enerji üretim süreci, bu özelliği sayesinde hücrelerin enerji merkezleri olarak adlandırılan mitokondride gerçekleşir. Ve vücudun her hücresinin çalışması için enerji sağlayan kimyasal reaksiyonların dizisine Krebs döngüsü denir.
Krebs döngüsü - mitokondride meydana gelen mucizeler
Krebs döngüsü (aynı zamanda TCA döngüsü - trikarboksilik asit döngüsü) yoluyla elde edilen enerji, bireysel hücrelerin ihtiyaçlarına gider ve bunlar da vücudumuzun çeşitli dokularını ve buna bağlı olarak organlarını ve sistemlerini oluşturur. Vücut enerji olmadan var olamayacağından mitokondri hücrelere ihtiyaç duydukları enerjiyi sürekli olarak sağlamak için sürekli çalışır.
Adenozin trifosfat (ATP) - bu bileşik vücudumuzdaki tüm biyokimyasal süreçler için gerekli olan evrensel bir enerji kaynağıdır.
TCA döngüsü, metabolitlerin oksidasyonunun tamamlandığı merkezi metabolik yoldur:
- yağ asitleri;
- amino asitler;
- monosakkaritler.
Aerobik parçalanma sırasında bu biyomoleküller, enerji üretmek veya yeni molekülleri sentezlemek için kullanılan daha küçük moleküllere parçalanır.
Trikarboksilik asit döngüsü 8 aşamadan oluşur; reaksiyonlar:
1. Sitrik asit oluşumu:

2. İzositrik asit oluşumu:

3. İzositrik asidin dehidrojenasyonu ve doğrudan dekarboksilasyonu.

4. α-ketoglutarik asidin oksidatif dekarboksilasyonu

5. Substrat fosforilasyonu

6. Süksinik asidin süksinat dehidrojenaz ile dehidrojenasyonu

7. Fumaraz enzimi ile malik asit oluşumu

8. Oksalasetat oluşumu

Böylece Krebs döngüsünü oluşturan reaksiyonların tamamlanmasından sonra:
- bir molekül asetil-CoA (glikozun parçalanması sonucu oluşur) iki molekül karbondioksite oksitlenir;
- üç NAD molekülü NADH'ye indirgenir;
- bir FAD molekülü FADN 2'ye indirgenir;
- bir molekül GTP (ATP'ye eşdeğer) oluşur.
NADH ve FADH2 molekülleri elektron taşıyıcıları olarak görev yapar ve glikoz metabolizmasının bir sonraki adımı olan oksidatif fosforilasyonda ATP üretmek için kullanılır.
Krebs döngüsünün işlevleri:
- katabolik (yakıt moleküllerinin asetil kalıntılarının nihai metabolik ürünlere oksidasyonu);
- anabolik (Krebs döngüsünün substratları - amino asitler ve glikoz dahil moleküllerin sentezinin temeli);
- bütünleştirici (TCC, anabolik ve katabolik reaksiyonlar arasındaki bağlantıdır);
- hidrojen donörü (mitokondriyal solunum zincirine 3 NADH.H + ve 1 FADH2 sağlanması);
- enerji.
Krebs döngüsünün normal işleyişi için gerekli olan elementlerin eksikliği, vücutta enerji eksikliğiyle ilişkili ciddi sorunlara yol açabilir.
Metabolik esneklik sayesinde vücut, enerji kaynağı olarak yalnızca glikozu değil, aynı zamanda parçalanması aynı zamanda piruvik asit oluşturan (Krebs döngüsünde yer alan) moleküller üreten yağları da kullanabilir. Böylece düzgün akan bir TCA döngüsü, yeni moleküllerin oluşumu için enerji ve yapı taşları sağlar.